背景:
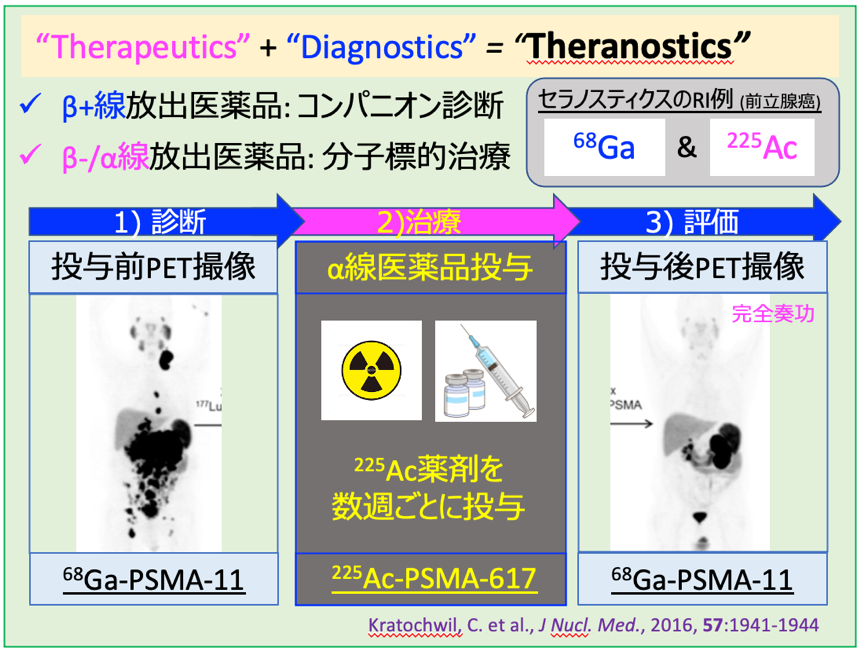
「放射性医薬品」とは、放射性同位体(RI)を用いた医薬品で、大きく分けて、「診断用」と、「治療用」の2つに分けられます。
まず1つ目の放射性医薬品を診断に用いる場合、特定の臓器や疾患部位に集積する薬剤とRIを結合させます。それを注射などで体内に投与し、集積した部位から放出されるγ線を体外の検出器で測定します。そのデータからγ線源の位置と強度を画像化することが可能で、例えばガンの体内分布などを知ることができます。実際の検査としては、C-11などのβ+線放出核を使うPET(陽電子断層撮影)や、Tc-99mなどのγ線放出核を使うSPECT(単一光子放射断層撮影)などが挙げられます。
2つ目が、「放射線内用療法」と呼ばれる放射性医薬品の治療への応用です。これは、β-線やα線、オージェ電子など、生物学的効果の高い放射線を放出するRIを、診断薬同様に特定部位に集積させ、放射線によって標的細胞を死滅させる、という方法です。中でもα線は、その細胞毒性の高さと飛程が短いことから、正常組織への被曝を最小限にしながら、標的組織への治療を可能にする「標的α線治療(Targeted Alpha Therapy : TAT)」として、注目を浴びています。
α線を放出するRIはさまざまな種類がありますが、Ac-225(半減期10日)は、TATに利用可能なRIの1つで、前立腺癌などの研究で良好な結果が報告されたのをきっかけに、需要が急速に高まっています。しかし、Ac-225は天然に存在せず、流通可能な絶対量が少ないため、核反応を用いて人工的に生成する必要があります。
研究手法:
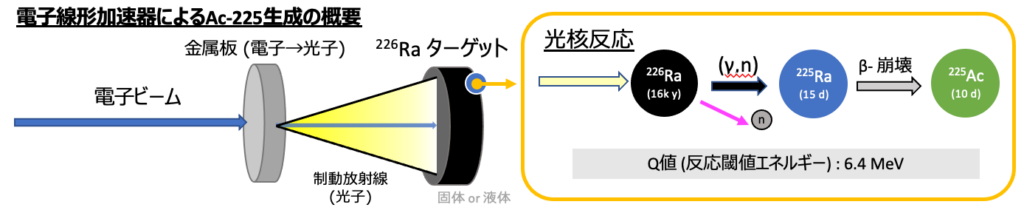
Ac-225の生成にあたり様々な手法が研究されていますが、私たちのグループでは加速器による生成の原理実証を進めています。具体的には、加速器による電子ビームを金属版に当て光子に変換し、その光子を標的物質のRa-226(半減期1600年)に照射します。すると、Ra-226の中で「光核反応」と呼ばれる核反応が起こり、Ra-226の一部がRa-225(半減期14.9日)になります。するとRa-225はβ-崩壊をしてAc-225になり、照射物の中からAc-225だけ分離することで、TAT用の薬剤の原料を得ることができる、という原理です。
話だけ聞くと簡単そうに思えるかもしれませんが、検討課題は沢山あります。例えば、標的物質であるRa-226はラドンガスを発生するため、何も対策をしないと周囲の環境を汚染してしまうため、照射装置の設計や照射前後の標的物質の取り扱いについては、安全管理上多くの考慮が必要となります。また、大強度のビームの照射に当たっては、装置の構造や材料にも工夫が必要なため、熱計算や放射化計算などで設計の妥当性を検討し、照射実験を通して装置の耐久試験・安全試験を行い、照射システム全体の評価を進めています。また、核反応をより多くするためのビームパラメータ探索や、照射後の化学分離工程の検討など、Ac-225生成プロセスの全体最適化も進めています。

研究の意義:
「Ac-225に代表されるα線放出核種の供給不足にむけて、加速器技術を用いたRI生成システムの原理実証を行う」のが研究の目的です。物理・工学・化学など、内容的に様々な分野にまたがり、安全管理など考慮すべき点も多く、難易度は非常に高いのですが、うまくいけば重要なRIを日本国内で生成できる可能性もあるため、学術的意義の大きいテーマだと言えます。
